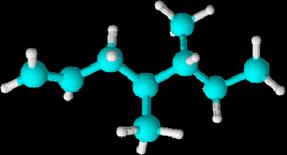
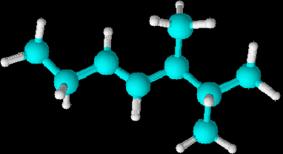
INTRODUCCIÓN
A LA QUÍMICA ORGÁNICA
Este tema
es una introducción a la química orgánica para los alumnos de 3º de ESO. Consta
de cuatro partes de las cuales las dos primeras forman parte del currículo
común para todos y las otras dos se presentan con carácter voluntario para
los alumnos que puedan estar interesados en ampliar conocimientos o adelantar
contenidos del curso de 4º de ESO.
Trataremos
de estudiar, con carácter general, los principales compuestos químicos que
constituyen las estructuras de los seres vivos.
Para
ello empezaremos por ver los elementos que intervienen en la construcción de
las moléculas, después veremos la base estructural de dichas sustancias y por
último los principales tipos de sustancias que constituyen dichos seres vivos.
Los
cuatro bloques son:
- Introducción
- Los elementos biogénicos
- El carbono
- Los hidrocarburos
- Qué son
- Tipos de hidrocarburos
- Formulación y nomenclatura
- Derivados de hidrocarburos
- Qué son
- Principales tipos de derivados
(funciones)
- Formulación y nomenclatura
- Las moléculas que forman los seres
vivos
- Qué son
- Tipos y características
1 -
Introducción
Objetivos
- Comprender
la relación entre unos términos que muchas veces usamos como sinónimos y
no lo son: Química Orgánica, Química del Carbono y Bioquímica
- Conocer
cuáles son los principales elementos químicos que forman parte de los
seres vivos
- Comprender
cómo es el carbono y cómo se explica a nivel atómico el comportamiento
observado en este elemento químico.
Conocimiento previo
Es importante repasar el tema del átomo, su estructura y el
comportamiento de los electrones. Además hay que repasar los tipos de enlace,
haciendo hincapié en el enlace covalente.
Antes
de empezar, vamos a aclarar unos conceptos muy sencillos pero fundamentales:
- La Química orgánica es la
"Química del carbono" y la base de la Bioquímica.
- En realidad, en la química
orgánica hay una parte de la química del carbono que no se incluye, es la
concerniente a los óxidos de carbono y a los carbonatos los cuales se
estudian en la química inorgánica.
- En la química orgánica no se trata
sólo la química de los seres vivos, también se estudian los compuestos
derivados del petróleo y todos los preparados químicos artificiales
formados a partir de cadenas carbonadas. Por eso no son sinónimos
- La Bioquímica es la ciencia que
estudia la química de los compuestos de los seres vivos.
Son
aclaraciones muy simplistas pero son importantes para comprender la importancia
que tiene el carbono y porque le dedicamos un apartado especial.
Elementos
biogénicos
Objetivos
Conocer los elementos químicos que intervienen en la
construcción de las moléculas que forman los seres vivos y su clasificación.
Conocer la diferencia entre elementos biogénicos
y oligoelementos.
La
materia viva está formada por elementos del sistema periódico, pero de ese
centenar de elementos conocidos sólo unos pocos son constituyentes de las
moléculas de los seres vivos.
Estos
elementos que constituyen las moléculas de los seres vivos reciben el nombre de
elementos biogénicos
Podemos
distinguir tres grupos en función de su importancia cuantitativa:
- Constituyen aproximadamente el 95%:
- Carbono (C), Hidrógeno (H), Oxígeno
(O) y Nitrógeno (N)
- Constituyen aproximadamente el 4'9%:
- Calcio (Ca), Magnesio (Mg),
Azufre (S), Fósforo (P), Cloro (Cl), Sodio (Na)
y Potasio (K).
- Constituyen el 0'1% restante y
reciben el nombre de oligoelementos.
A pesar de su escasez, son fundamentales para la vida. Los más importantes
son:
- Hierro (Fe), Cobre (Cu), Plomo
(Pb), Manganeso (Mn) y Cinc (Zn).
Principios
inmediatos
Objetivos
- Comprender
el concepto de principios inmediatos.
- Conocer y
comprender la clasificación de los principios inmediatos.
- Recordar
cosas fundamentales de los principios inmediatos inorgánicos.
Los
Principios Inmediatos son las moléculas que se forman al
combinarse entre sí los elementos biogénicos.
Modificaciones
y combinaciones de los principios inmediatos darán lugar a la formación de las
moléculas orgánicas.
Podemos
distinguir dos grandes grupos:
- Principios
Inmediatos Inorgánicos.
- Son aquellos cuyo elemento
principal no es el carbono (Agua, sales minerales, gases en disolución,
etc.)
- Los habéis estudiado en Química
Inorgánica. Les dedicaremos un apartado en esta sección.
- Principios
Inmediatos Orgánicos.
- Se caracterizan por tener al
carbono como elemento principal. El carbono se une con otros átomos de
carbono formando una estructura básica a la que se incorporan otros
elementos, fundamentalmente hidrógeno y oxígeno. (Hidrocarburos y sus
derivados)
- Constituyen el núcleo de esta
introducción a la Química Orgánica. Se estudiarán en sus secciones
correspondientes.
AGUA
- El agua es el principal disolvente
de la naturaleza, y en los seres vivos no se produce una excepción.
- Es el medio en el cual transcurren
casi todas las reacciones químicas.
- Gracias al agua pueden entrar
nutrientes en las células y salir productos de desecho.
SALES MINERALES
Pueden
aparecer como sales cristalinas formando esqueletos y caparazones o disueltas
en agua en forma de iones.
Los
más importantes son:
- Aniones: Cl-, (H2PO4)-,
(HPO4)=, (SO4)=.
- Cationes: Na+,
K+, (NH4)+, Ca++, Mg++.
La
concentración de sales del agua de la materia viva es similar a la del agua de
mar.
Las
funciones que desempeñan las sales en los seres vivos son muy variadas:
- Son imprescindibles para regular el
pH y la presión osmótica de las células
- Favorecen el impulso nervioso y la
contracción muscular.
- Forman órganos esqueléticos, etc.
GASES DISUELTOS
Los
más importantes son:
- El oxígeno (O2)
Fundamental para el metabolismo energético de las células.
- El dióxido de carbono
o anhídrido carbónico (CO2) Fundamental para el proceso
fotosintético.
El
carbono
Objetivos
Antes de seguir adelante con los hidrocarburos y sus derivados, nos
conviene conocer un poco mejor al carbono, por lo que le vamos a dedicar un
apartado especial que nos permitirá entender mejor el comportamiento que tiene
en estas estructuras de los seres vivos.
Conocimiento previo
Repasa los conceptos de distribución (diagrama de Möeller) y configuración electrónica.
Repasar el concepto de orbital.
PRÓLOGO
- Sólo pretende despertar vuestra inquietud... que miréis con otros ojos al
principal elemento químico de vuestros cuerpos.
Es
curioso observar que hay en la naturaleza dos elementos químicos, muy próximos
entre si en la tabla periódica, que tienen una
importancia capital en el mundo animado e inanimado respectivamente, son: el
carbono y el silicio. Ambos están en el grupo IVa y alcanzan
gran estabilidad al completar su dotación electrónica con 4 electrones
conseguidos mediante enlaces covalentes, y ambos pueden presentar una
estructura tridimensional tetraédrica de gran simetría (el tetraedro es el
primer cuerpo geométrico regular) que les permite ser el armazón de estructuras
moleculares covalentes muy complejas.
Aunque
existen más elementos en ese mismo grupo, tienen pesos atómicos mucho mayores
que alteran sus propiedades ya que existe una proporcionalidad inversa entre el
peso atómico y la estabilidad del enlace.
Pero...
¿Qué hizo que fuese el carbono el elemento principal de los seres vivos y no el
silicio?
–Probablemente
la diferencia en sus pesos atómicos, menor en el carbono (12'01u) que en el
silicio (28'08u) Los seres vivos realizan constantes transformaciones químicas
(movimientos de materia y energía) por lo que necesitan mucha energía en la
menor cantidad de materia posible...
Pero
todo esto que he dicho... "sólo" es para haceros pensar... ¿Cuál es
el origen de estas maravillosas moléculas de carbono que forman los seres
vivos? ¿Qué chispazo de la Creación disparó la formación de esos sistemas
moleculares que constituyen eso que llamamos "ser vivo"?
Un
elemento muy especial
El
carbono tiene dos características que hacen que sea un elemento muy especial
del que se conocen más de dos millones de compuestos, estas son
- Su tetravalencia
- La estabilidad de los enlaces C-C
Si
analizamos el átomo de carbono observamos que presenta 6 neutrones y 6 protones
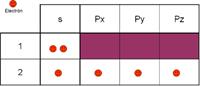
en el núcleo y 6 electrones en la corteza.
Estos
electrones se distribuyen por la corteza formando unas nubes llamadas
orbitales: 2 e- forman el orbital 1s del primer nivel energético, otros 2 e-
forman el orbital 2s del segundo nivel energético y los otros 2 e- forman 2 orbitales
2p (2px y 2py) en el segundo nivel energético.(Esto explicaría el compuesto
CO).
Observa
su configuración 1s2 2s2 2p2 o
mejor 1s2 2s2 2px1 2py1 2pz0
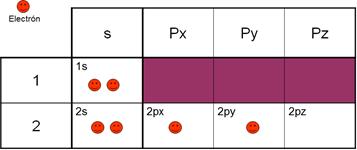
Sin
embargo las cosas no son tan sencillas ya que en la "búsqueda" de su
estabilidad energética el átomo de carbono se tiene que "adaptar" a
las circunstancias del momento y sus electrones pueden saltar dentro de su
nivel energético apareciendo 4 electrones desapareados formando otros tantos
orbitales.
Observa
cómo cambia su configuración a 1s2 2s1 2p3
o mejor 1s2 2s1 2px1 2py1 2pz1
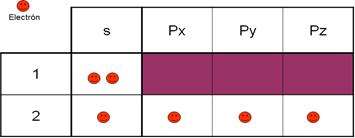
Este
cambio en la configuración es posible debido a que la diferencia de energía
entre sus orbitales 2s y 2p es muy pequeña, permitiendo el salto de ese
electrón del 2s al 2pz.
Cuando
estéis en bachillerato y estudiéis más en profundidad a los electrones y sus
relaciones energéticas, comprenderéis mejor estos comentarios algo simplistas.
De
momento nos basta para comprender esa tetravalencia
mágica del carbono y para asomarnos al conocimiento de otra maravilla... las
"hibridaciones"
Las
hibridaciones del carbono
Objetivos
- Ver cómo
los científicos pueden deducir propiedades de los átomos a partir de
observaciones experimentales.
- Comprender
el concepto de hibridación.
- Comprender
la importancia de las hibridaciones en el comportamiento del carbono.
Conocimiento previo
- Busca
imágenes en Internet sobre los distintos tipos de orbitales.
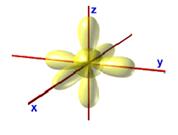
Los cuatro orbitales de la capa 2,
pueden, en principio, permanecer "puros", pero no explicarían los
enlaces que se forman al unirse un carbono con otro.
En
la realidad se combinan los orbitales "p" con el orbital
"s" dando lugar a diversas variantes que denominamos hibridaciones.
Estas
hibridaciones explicarían los diferentes tipos de enlaces que se pueden formar
entre dos carbonos:
- Enlace Simple (hibridación sp3)
- Enlace Doble (hibridación sp2)
- Doble enlace doble (hibridación sp1)
*
- Enlace Triple (hibridación sp1)
La
configuración: 1s2 2s1 2p3, para el átomo de carbono explica su tetravalencia, pero no explica el que los cuatro enlaces
C—H del metano (CH4) sean idénticos como prueban la existencia de un
solo derivado monoclorado (ClCH3) y de un
sólo derivado diclorado (Cl2CH2).
Así, la forma de los orbitales de valencia del carbono, con un electrón en cada
orbital, sería la siguiente:
Según
esto, los cuatro átomos de hidrógeno del metano se dispondrían así:
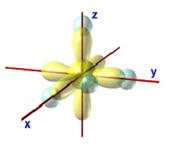
Esta
disposición es incompatible con la conocida equivalencia de los cuatro enlaces
C—H del metano. Por otra parte los espectroscopistas
insisten en que el ángulo entre cada dos enlaces C—H del metano es de 109° 28‘.
Lo
que sólo puede estar de acuerdo con una estructura como esta:
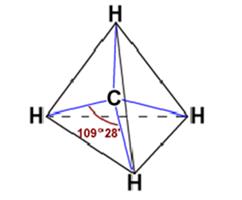
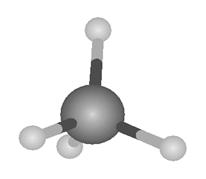
Es
evidente que a los orbitales del átomo de carbono aislado les ocurre «algo»
cuando el átomo de carbono se combina con otros cuatro átomos.
Según
Pauling,
el átomo de carbono se dispone situando cada uno de los cuatro electrones de
valencia en uno de los cuatro orbitales idénticos que se forman a partir del
orbital 2s y de los tres orbitales 2p.
El
proceso de formación de estos nuevos orbitales combinados, se denomina
hibridación y cada uno de los orbitales formados es un orbital híbrido.
En
realidad los orbitales que llamamos y dibujamos monolobulados,
no son tales, sino que tienen un segundo lóbulo más pequeñito que aquí se omite
para no complicar los dibujos; en algún dibujo posterior podrás observarlos.
.
.
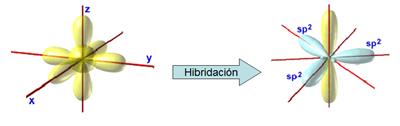
El
nombre de las hibridaciones, sp1, sp2 y sp3, nos indica el número de orbitales
p que se hibridan con el orbital s.
Observa
que en todas las hibridaciones dejamos de tener un orbital 2s como
tal (desaparece el orbital esférico).
Por
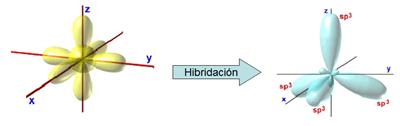
la estructura de los orbitales hibridados, las hibridaciones se llaman:
- La sp3 - tetragonal
- La sp2 - trigonal
- La sp1 - digonal
.
Es
muy importante que aprendas a interpretar bien todas las imágenes y a crear las
tuyas propias.
.
.
Otra
cosa interesante, que nosotros no estudiamos pero que verás en los dibujos, es
la aparición de dos tipos de enlaces covalentes.
- Los que se dan entre orbitales
hibridados "enlaces sigma σ"
- Los que se dan entre orbitales no
hibridados "enlaces pi π"
Aunque
los dibujos son un poco engañosos, los orbitales no hibridados, a pesar de ser
bilobulados, sólo tienen un electrón y por lo tanto sólo comparten un
electrón.
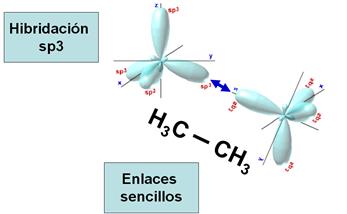
Hibridación
sp3 o tetragonal
La
hibridación sp3 se produce cuando el orbital s se hibrida con los tres
orbitales p. Es la que podríamos llamar la hibridación
"fundamental", pero no lo haremos. En el dibujo azul podéis observar
los lobulitos pequeños.
Los
orbitales amarillos son los que no están hibridados y los azules los que sí.
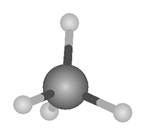
Es
la hibridación típica del carbono del metano y de todos los alcanos.
También de la mayoría de los átomos de carbono de las cadenas de los otros
hidrocarburos y de los derivados de hidrocarburos. Es la responsable de los
enlaces sencillos del carbono, en los que sólo comparte un electrón.
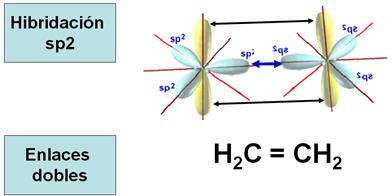
Hibridación sp2 o trigonal
La hibridación sp3 no es la única que adopta el átomo
de carbono, pues en la formación de enlaces dobles, el carbono adopta la
hibridación trigonal, sp2.
Como
indica su denominación, en la hibridación sp2 intervienen un orbital s (el
2s) y dos orbitales p (los 2px y 2py).
En
esta ocasión, los orbitales híbridos se disponen en un plano formando ángulos
de 120°, siendo el conjunto perpendicular al orbital 2pz que queda sin
hibridar.
Los
orbitales amarillos son los que no están hibridados y los azules los que sí.
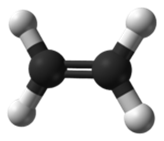
Este tipo de hibridación se da en los casos de
formación de doble enlace: carbono-carbono, por ejemplo, en la molécula de
etileno: CH2 = CH2 (eteno). los dos
carbonos del eteno presentan hibridación sp2, por eso pueden unirse con un
doble enlace (comparten dos electrones de cada carbono)
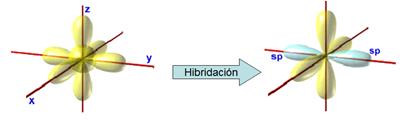
Hibridación sp1 o digonal
El átomo de carbono aún puede sufrir otro tipo de
hibridación, la hibridación digonal sp1.
Como indica su nombre, en ella intervienen un
orbital s (el 2s) y otro p (el 2py).
Los orbitales 2px y 2pz que no intervienen en la
hibridación conservan su forma y posición.
En esta ocasión los orbitales híbridos se disponen
alineados formando ángulos de 180°, y dirigidos según el eje OY.
Los orbitales amarillos son los que no están
hibridados y los azules los que sí.
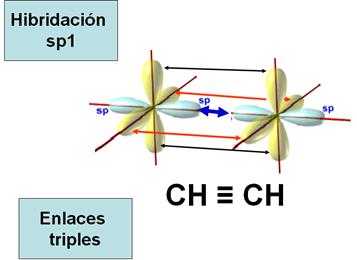
Este tipo de hibridación se da en los casos de
formación de triple enlace: carbono-carbono, por ejemplo, en la molécula de
acetileno: CH ≡ CH (etino). Los dos carbonos del etino sufren una
hibridación sp1 y gracias a eso pueden establecer un enlace triple entre ellos.
En este tipo de enlace cada carbono comparte tres electrones.

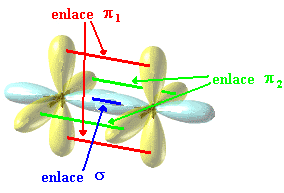
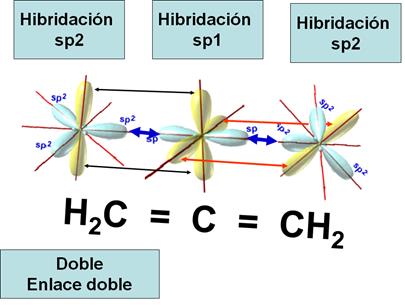
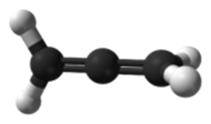
También se da cuando un carbono tiene doble enlace
con los dos carbonos que se enlazan con él. H2C=C=CH2. El
carbono central del 1,2-propadieno presenta hibridación sp1 y los otros dos
presentan hibridación sp2
2 - Los
Hidrocarburos
Objetivos
- Saber qué
son y qué caracteriza a los hidrocarburos.
- Comprender
el significado de los prefijos que vemos en los nombres de los
hidrocarburos y posteriormente en sus derivados.
- Ver una
clasificación sencilla de los hidrocarburos.
Los hidrocarburos son compuestos
orgánicos formados por cadenas de átomos de carbono que pueden estar
ramificadas, de las que "cuelgan" átomos de hidrógeno. La estructura
molecular consiste en un armazón de átomos de carbono a los que se
unen átomos de hidrógeno.
Para nombrarlos se usan unos
prefijos que indican el número de carbonos, y unos sufijos que indican el tipo:
El
número de carbonos de la cadena principal se indica con las siguientes raíces:
Met- si tiene 1 átomo de carbono
Et-
si tiene 2 átomos de carbono
Prop- si tiene 3 átomos de carbono
But- si tiene 4 átomos de carbono
•
A partir de aquí ya sigue la nomenclatura habitual (recuerda la de geometría)
Penta- si tiene 5 átomos de carbono
Hexa- si tiene 6 átomos.
...etc.
Los
sufijos los veremos al estudiar cada caso
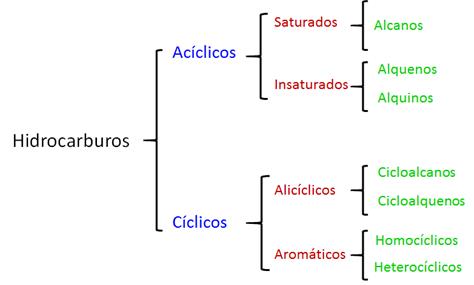
Clasificación de los hidrocarburos
Encontramos
tres tipos de hidrocarburos en función de los tipos de enlaces:
- Alcanos
- Alquenos
- Alquinos
Además,
podemos distinguir según sea la cadena de carbonos:
- Acíclicos (cadena lineal)
- Ramificados
- Cíclicos
El siguiente cuadro nos puede
ayudar a comprender mejor la clasificación de los hidrocarburos.
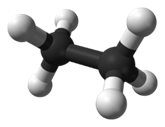
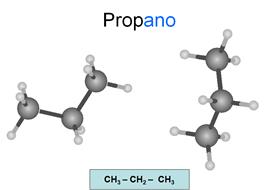
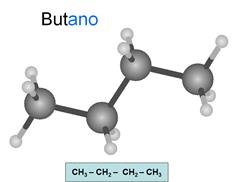
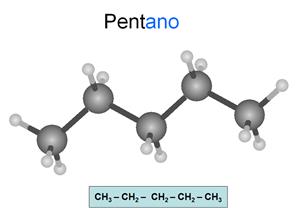
Alcanos
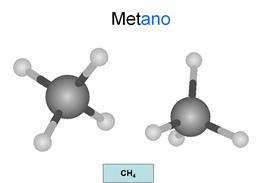
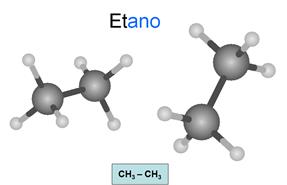
Son hidrocarburos saturados. Esto significa que
todos los enlaces entre carbonos son simples. Los átomos oscuros son carbonos y
los claros son hidrógenos.
Su fórmula general es CnH2n+2.
Se nombran con la terminación ano.
Observa como las líneas de los enlaces de cada
carbono conservan la estructura del teraedro... Todos
los carbonos presentan hibridación sp3, es decir, hibridación tetragonal.
Los carbonos son tetravalentes: Cada carbono
presenta 4 enlaces, pudiendo unirse con cada uno a otro carbono o a un
hidrógeno. Es importante que tengas esto en cuenta en todos los compuestos que
estudies y que seas capaz de relacionar los dibujos con las fórmulas.
Alquenos
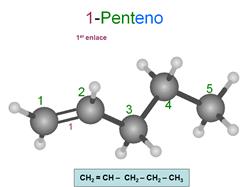
Son hidrocarburos insaturados, esto significa que existen
enlaces entre carbono que no son sencillos.
Se caracterizan porque por lo menos dos de sus
carbonos están unidos entre sí por un enlace doble. En algunos dibujos no te
representarán el doble enlace con dos palitos, y tendrás que reconocer su
presencia por el número de hidrógenos.
Su fórmula general es CnH(2n+2)-2x
donde "x" es el número de dobles enlaces.
Se nombran con la terminación eno,
indicando además el lugar donde está o están los dobles enlaces.
Para elegir la cadena principal se coge la más
larga que tenga el doble enlace. Si hay varios dobles enlaces, se coge la que
contenga el mayor número aunque no sea la más larga. Esto cobra sentido cuando
hay ramificaciones.
Para numerar los carbonos, se empieza por el
extremo que tiene más cerca un doble enlace.
Es muy importante fijarse en la forma de separar,
sin dejar espacios, los números entre sí con comas y de las letras con
guiones.
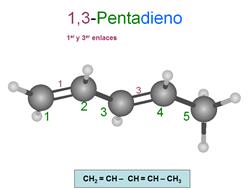
Observa que se pierde la estructura del tetraedro
en los carbonos afectados por un doble enlace. La hibridación de los carbonos
que participan de un doble enlace, por ejemplo el 1 y el 2 del
1-penteno, es trigonal, es decir sp2, no tetragonal.
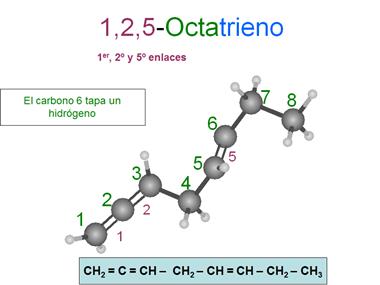
Observa que en el 1,2,5-octatrieno hay un carbono, el carbono
2, afectado por dos dobles enlaces. La hibridación de estos
carbonos afectados por dos dobles enlaces es digonal,
es decir sp1.
¡Importante!
Actualmente existe otra nomenclatura que adquiere
su importancia cuando las cosas se complican, por ejemplo por la presencia de
radicales. En nuestros ejemplos, los nombres serían:
Pent-1-eno
Penta-1,3-dieno
Octa-1,2,3-trieno
Esta nomenclatura permite colocar delante la
referencia a las otras características del compuesto, pero esto lo veremos en
su momento.
Observa que si quitamos los números, podemos leer
la palabra sin problemas: "penteno", "pentadieno" y "octatrieno".
Más adelante, verás que hablan de dobles enlaces:
Aislados - Cuando están separados
por más de un enlace simple -C=C-C-C=C-
Conjugados - Cuando sólo los
separa un enlace simple -C=C-C=C-
Acumulados - Cuando están
seguidos -C=C=C-
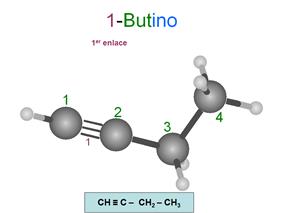
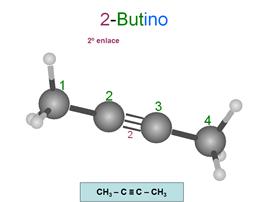
Alquinos
Son hidrocarburos insaturados. Se caracterizan
porque al menos dos de sus carbonos están unidos entre sí por un triple enlace.
Su fórmula general es CnH(2n+2)-4x
donde "x" es el número de triples enlaces.
Se nombran con la terminación ino indicando además la posición
de los triples enlaces.
Para numerar los carbonos, se empieza por el
extremo que tiene más cerca un triple enlace.
Observa que no puede haber dos enlaces triples
seguidos ya que el carbono situado en medio tendría que tener valencia 6.
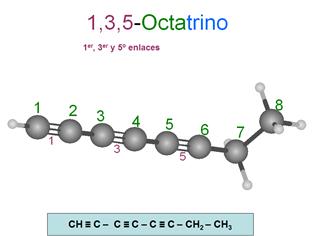
Observa la molécula o la fórmula del 1,3,5-octatriino.
Si te fijas en el carbono 1, comparte un electrón con su hidrógeno y los otros
tres con el carbono 2, completando su tetravalencia.
Si nos fijamos en el carbono 2, comparte tres electrones con el carbono 1 y el
cuarto electrón con el carbono 3. Estudia los otros carbonos buscando su tetravalencia, se debe cumplir siempre.
.
¡Importante!
Actualmente existe otra nomenclatura que adquiere
su importancia cuando las cosas se complican, por ejemplo por la presencia de
radicales. En nuestros ejemplos, los nombres serían:
But-1-ino
But-2-ino
Octa-1,3,5-triino
Esta nomenclatura permite colocar delante la
referencia a las otras características del compuesto, pero esto lo veremos en
su momento.
Observa que si quitamos los números, podemos leer
la palabra sin problemas: "butino" y "octatriino".
Radicales
Son los compuestos que se forman cuando un
hidrocarburo pierde un hidrógeno de un carbono terminal quedando éste con un
electrón desapareado, por lo que tenderá a unirse con otros compuestos.
Son
sustancias de transición en las reacciones, pero guardan su propia identidad al
unirse al otro compuesto.
Radicales
alquilo
Son
los que se forman a partir de un alcano, por lo que todos los enlaces entre
carbonos son sencillos. Se nombran con las terminaciones "ilo" cuando están sueltos y con "il" cuando están ligados a otra cadena.
Los
carbonos se empiezan a contar desde el que ha perdido el hidrógeno.
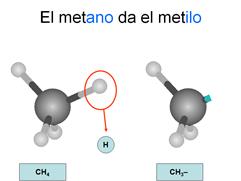
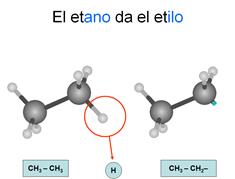
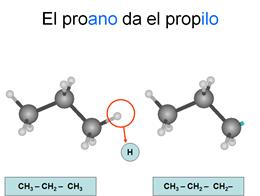
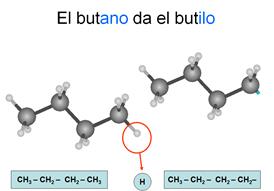
Recuerda: Cuando estos radicales se unen a otras cadenas, cambian la
terminación "ilo" por la terminación "il"
Encontramos
ciertos radicales que están ramificados y tienen nombres propios que se siguen
usando. Recuerda que al unirlos a una cadena, también ellos cambian la
terminación "ilo" por "il".

Radicales
alquenilo y alquinilo.
Son
los que se forman a partir de alquenos y alquinos respectivamente. Estos
radicales adoptan las terminaciones “-enilo” ó “-inilo” o "-enil" e "inil"
cuando están ligados a otra cadena.
Algunos
de estos radicales tienen nombres comunes aceptados por la IUPAC, el nombre
sistemático de los mismos se encuentra entre paréntesis. Se empieza siempre a
numerar por el extremo donde se ha perdido el hidrógeno. Ejemplos:

Veamos
las moléculas de tres ejemplos:

1,3-pentadiinilo
1-Propenilo
2-propenilo
El
2-propenilo presenta un reto visual ¿Dónde está el doble enlace? Justifícalo.
Hidrocarburos
de cadenas ramificadas
Alcanos de cadenas ramificadas
Se
forman cuando uno o varios hidrógenos de carbonos intermedios son sustituidos
por radicales.
Se
nombran primero los radicales con el sufijo "il",
en orden alfabético, indicando delante de cada uno el carbono sobre el que
se encuentra y al final del todo el nombre de la cadena principal.
Para
hacer esto:
- Hay que asegurarse de escoger la
cadena más larga como cadena principal. Si hubiese dos opciones igual
de largas cogeríamos la que tuviese mayor número de radicales.
- Numerar la cadena principal de
manera que asignemos los números más bajos a los carbonos con radicales.
- Nombrar primero las cadenas
laterales, por orden alfabético, precedidas de su número localizador.
- Terminamos añadiendo al nombre del
último radical el de la cadena principal
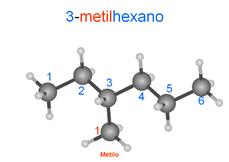
Para
escribir las fórmulas de estos compuestos ponemos los radicales
entre paréntesis justo después del carbono al que se unen:
3-metilhexano
CH3-CH2-CH(CH3)-CH2-CH2-CH3
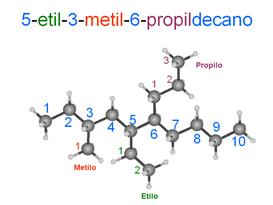
5-etil-3-metil-6-propildecano
CH3-CH2-CH(CH3)-CH2-CH(CH2-CH3)-CH(CH2-CH2-CH3)-CH2-CH2-CH2-CH3
Estas
fórmulas se suelen escribir sin los guiones:
3-metilhexano
CH3CH2CH(CH3)CH2CH2CH3
5-etil-3-metil-6-propildecano
CH3CH2CH(CH3)CH2CH(CH2CH3)CH(CH2CH2CH3)CH2CH2CH2CH3
Fíjate bien en este otro ejemplo: Compara el nombre con la fórmula. ¿Qué tendrías
que cambiar en la molécula del 5-etil-3-metil-6-propildecano?
3,3-dimetil-6-propildecano
CH3CH2C(CH3)2CH2CH2CH(CH2CH2CH3)CH2CH2CH2CH3
Vimos también que había radicales "especiales" aquí tienes dos
ejemplos.
5-isopropilnonano 5-terbutilnonano
Alquenos de cadenas ramificadas
Se
forman cuando uno o varios hidrógenos de carbonos intermedios son sustituidos
por radicales. Lo que hemos dicho para los alcanos, se lo podemos aplicar a los
alquenos, pero se nos complica todo por la presencia de los dobles enlaces.
Para
elegir la cadena principal se coge la más larga que tenga el doble enlace. Si
hay varios dobles enlaces, se coge la que contenga el mayor número aunque no
sea la más larga.
Para
numerar los carbonos, se empieza por el extremo que tiene más cerca un doble
enlace. Esto tiene prioridad sobre la presencia de radicales.
Para
nombrarlos, sí se empieza por los radicales.
Ejemplos:
|
CH2=CH-CH2-CH-(CH3)-CH-(CH3)-CH2-CH3 4,5-dimetil-1-hepteno
o 4,5-dimetil-hept-1-eno
|
CH3-CH2-CH=CH-CH-(CH3)-CH-(CH3)-CH3 5,6-dimetil-3-hepteno
o 5,6-dimetil-hept-3-eno
|
.
CH3-CH2-C-(CH3)2-CH2-CH=C=CH2
5,5-dimetil-1,2-heptadieno o 5,5-dimetil-hepta-1,2-dieno
Cíclicos
Cicloalcanos
Se
nombran añadiendo el prefijo ciclo al nombre del alcano de cadena
abierta equivalente.:
Estas
son las moléculas del ciclohexano y
el ciclopentano
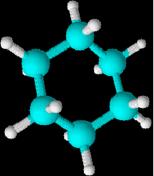
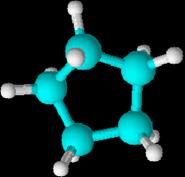
Cuando
tienen radicales se nombran con los mismos criterios que en los alcanos
lineales.
En
los ciclos no hay carbono inicial ni final a priori y es la presencia de los
grupos añadidos lo que hace que haya un carbono 1
1-etilciclohexano
o etilciclohexano ya que es la presencia del
etilo la que hace que ese carbono sea el carbono 1
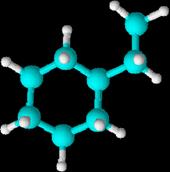
Los radicales derivados de los cicloalcanos se nombran sustituyendo la
terminación -ano por -ilo, o -il
igual que en los alcanos acíclicos.
En el ejemplo tenemos el
1,4-diciclohexil-2-metilbutano
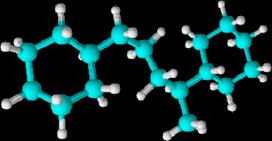
Cicloalquenos
Se
nombran añadiendo el prefijo ciclo al nombre del alqueno
de cadena abierta equivalente. Observa estos tres compuestos:
1,4-ciclohexadieno, 1,3-ciclohexadieno y 1,3,5-ciclohexatrieno
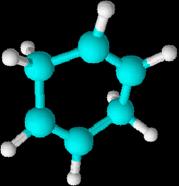
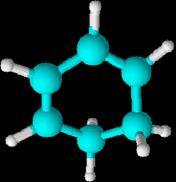
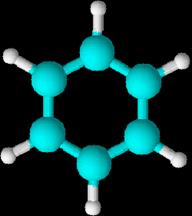
(este
último es el benceno)
Cuando
tienen radicales, el doble enlace tiene preferencia en el momento de numerar
(los localizadores 1 y 2 corresponden a los carbonos del doble enlace).
Tenemos
como ejemplos
el 3-metilciclopenteno y el 3,3-dimetilciclopenteno
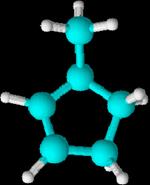
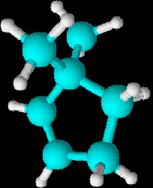
Aromáticos
Reciben
este nombre debido a sus olores intensos.
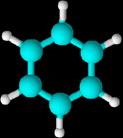
Hidrocarburos aromáticos monocíclicos.
Todos
ellos se pueden considerar derivados del benceno, que es una molécula cíclica,
de forma hexagonal y con un orden de enlace intermedio entre un enlace sencillo
y un doble enlace. (Experimentalmente
se comprueba que los seis enlaces son equivalentes, de ahí que la molécula de
benceno se represente como una estructura resonante entre las dos fórmulas
propuestas por Kekulé.)
Los hidrógenos pueden sustituirse
por radicales
Con
un sólo sustituyente: El sustituyente se nombra como radical y después se añade
la palabra "-benceno".
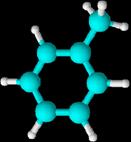
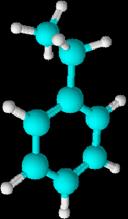
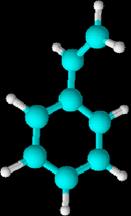
Metilbenceno etilbenceno etenilbenceno
Con
dos sustituyentes: Se indica su posición relativa dentro
del anillo bencénico mediante los números 1,2; 1,3 ó
1,4, teniendo el número 1 el sustituyente que va antes en orden alfabético.
Se
siguen utilizando los prefijos "orto" (o-), "meta" (m-) y
"para" (p-) para indicar esas mismas posiciones, a continuación se
nombran los radicales y finalmente la palabra "-benceno". No se puede
poner el nombre del prefijo, sólo la letra.
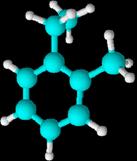
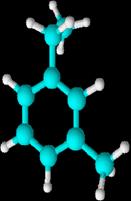
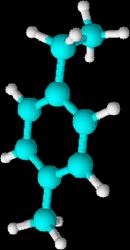
1-etil-2-metilbenceno 1-etil-3-metilbenceno 1-etil-4-metilbenceno
(o-etilmetilbenceno) (m-etilmetilbenceno)
(p-etilmetilbenceno)
Tres
sustituyentes: Se procura que reciban los números más
bajos posibles y en el caso de que existan varias opciones, daremos
preferencia al que vaya primero en el orden alfabético.
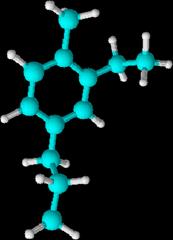
2-etil-1-metil-4-propilbenceno
Hidrocarburos aromáticos policíclicos
Son los que presentan varios anillos juntos
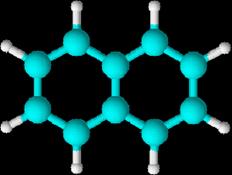
Naftaleno
Combinaciones
Hidrocarburos con dobles y triples enlaces
Al
nombrarlos hay que enunciar tanto el número de dobles enlaces como el de
triples: si hay dos enlaces dobles y uno triple, será un -dieno
-ino; si hay tres enlaces dobles y dos triples
será un –trieno -diino;
etc. Para nombrar la cadena principal se procura que recaigan los números más
bajos en el mayor número de insaturaciones posibles
(enlaces dobles y triples), prescindiendo de considerar si son dobles o
triples. En el caso de que los localizadores de las insaturaciones
coincidan se da preferencia a los dobles enlaces sobre los triples y siempre
son los dobles enlaces los que dan nombre al hidrocarburo.
Ejemplos:
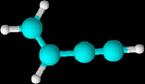
1-buten-3-ino CH2=CH-C≡CH
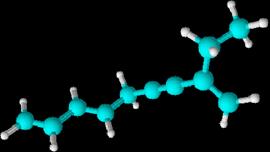
3-octeno-1,7-diino
CH≡C-CH2-CH2-CH=CH-C≡CH

También con radicales
8-etil-1,3,8-nonatrien-6-ino
CH2=CH-CH=CH-CH2-C≡C-C(CH3-CH2)=CH
Códigos QR de realidad
aumentada para acceder a los vídeos de formulación y nomenclatura orgánica (Necesitas
una app gratuita para leer códigos QR con el móvil):


Vídeo 1 formulación Vídeo 2 nomenclatura